Texto: Darcy Borrero
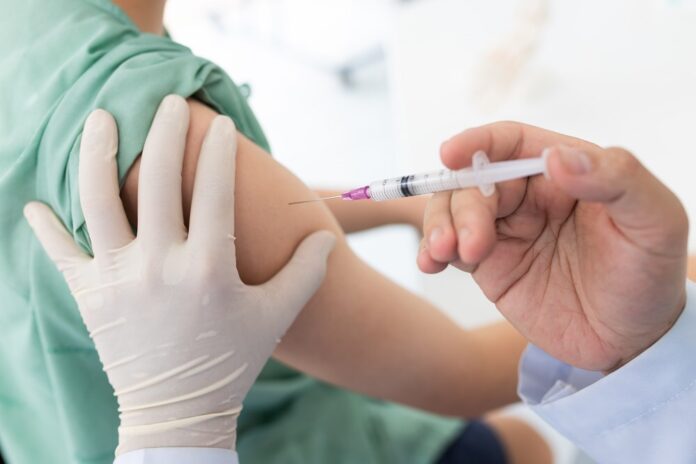
El jueves 10 de diciembre, tras horas de debate sobre la vacuna de Pfizer/BioNTech contra el coronavirus, se tomó una decisión en Estados Unidos. El comité asesor de vacunas de la Administración de Medicamentos y Alimentos (FDA, por sus siglas en inglés) recomendó que se autorice el uso de emergencia de esta vacuna, que ya se utilizaba en gran medida en Reino Unido.
Bajo la sección 564 de la Ley Federal de Alimentos, Medicamentos y Cosméticos (21 USC 360bbb-3), la FDA tiene la autoridad para permitir el uso de productos médicos no aprobados o usos no autorizados de productos aprobados en situaciones de emergencia para diagnosticar, tratar o prevenir enfermedades serias o potencialmente mortales, siempre que se cumplan ciertos criterios legales, incluido el hecho de que no existan alternativas adecuadas y disponibles.
“El 10 de diciembre de 2020, el Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC) del Centro de Evaluación e Investigación Biológica (CBER) se reuniría en una sesión abierta para discutir la Autorización de Uso de Emergencia (EUA) de la vacuna Pfizer-BioNTech COVID-19 para la prevención de COVID-19 en personas de 16 años o más”, exponía el sitio web de la FDA antes de que se emitiera este nuevo veredicto.
“Es vital que la decisión final sobre la autorización de la vacuna para uso de emergencia sea tomada por los funcionarios de carrera de la FDA”, declaró la agencia tras evaluar si, a partir de la evidencia científica disponible, existe razón suficiente para creer que la vacuna Pfizer-BioNTech COVID-19 es efectiva para prevenir COVID-19 en personas de 16 años o más. También debieron considerar si los beneficios conocidos y potenciales de la vacuna superan los riesgos conocidos y potenciales para su uso en ese grupo etario.
En este contexto, un informe señala que los datos presentados en esta solicitud de EUA fueron consistentes con las recomendaciones de la FDA sobre Autorización de Uso de Emergencia para Vacunas contra COVID-19 y cumplieron con los criterios de éxito a priori establecidos en el protocolo.
¿Qué tan efectiva es la vacuna de Pfizer/BioNTech?
Los análisis intermedios y finales mostraron que la eficacia de la vacuna, siete días después de la segunda dosis, fue del 95% en participantes sin evidencia previa de infección por SARS-CoV-2 y alrededor del 94% en aquellos con o sin infección previa. Los resultados de eficacia se valoraron como consistentemente sólidos (≥93%) en todos los subgrupos demográficos.
Sin embargo, se registraron seis muertes (2 en el grupo de vacuna y 4 en el de placebo) entre los 43,448 participantes del estudio (0.01%) entre el 29 de abril de 2020 y el 14 de noviembre de 2020. Los dos receptores de la vacuna eran mayores de 55 años; uno sufrió un paro cardíaco 62 días tras la segunda dosis y falleció tres días después, mientras que el otro murió de arteriosclerosis tres días tras la primera vacuna. El informe subraya que estas muertes reflejan eventos que ocurren en la población general para las edades en cuestión, a una tasa similar.
Las reacciones adversas más comunes fueron localizadas en el lugar de la inyección, así como fatiga, dolor de cabeza, dolor muscular, escalofríos, dolores articulares y fiebre. Además, se reportaron cuatro casos de parálisis de Bell en el grupo de vacuna frente a ninguno en el grupo de placebo, aunque el informe aclara que estos cuatro casos no superan la frecuencia esperada.
Primeras reacciones y lecciones de la vacunación masiva en Reino Unido
Tras el caso de dos trabajadores de la salud que presentaron síntomas al día siguiente de recibir la vacuna de Pfizer/BioNTech, las autoridades sanitarias del Reino Unido aconsejaron que aquellas personas con un “historial significativo de reacciones alérgicas” no deben recibir este antídoto.
Según un informe de CNN, ambos mostraron reacciones adversas tras recibir su inyección en el primer día de la campaña masiva de vacunación en el Reino Unido, según lo indicado por el Servicio Nacional de Salud de Inglaterra (NHS England).
En un comunicado emitido el miércoles, Pfizer advirtió que sus ensayos no incluyeron a personas con “antecedentes de reacciones adversas graves asociadas con una vacuna y/o reacciones alérgicas graves a cualquier componente de la intervención del estudio”.
El consejo de precaución de las autoridades británicas se emitió después de que se conocieran las reacciones de dos miembros del personal, quienes llevaban un autoinyector de adrenalina y tenían antecedentes de reacciones alérgicas.
“Ambos se están recuperando bien”, señala un comunicado de NHS England, donde también se indica que la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA por sus siglas en inglés) recomienda que las personas con un historial significativo de reacciones alérgicas eviten esta vacuna.
Otra vacuna contra el coronavirus: en discusión la de ModernaTX, Inc.
El próximo 17 de diciembre de 2020, el Comité que revisa y evalúa los datos relacionados con la seguridad, eficacia y uso adecuado de vacunas y productos biológicos se reunirá en sesión abierta para discutir la Autorización de uso de emergencia (EUA) de la vacuna COVID-19 de ModernaTX, Inc. para la prevención de COVID-19 en personas mayores de 18 años. La autoridad de la EUA permite a la FDA fortalecer las protecciones de salud pública de la nación contra amenazas químicas, biológicas, radiológicas y nucleares (QBRN) facilitando la disponibilidad y el uso de contramedidas médicas necesarias durante emergencias de salud pública.
“Estamos comprometidos a acelerar el desarrollo de vacunas COVID-19, pero no a expensas de la ciencia sólida y la toma de decisiones. No pondremos en riesgo la confianza del público en nuestra revisión independiente y basada en la ciencia de estas o cualquier otra vacuna. Hay mucho en juego”. Estas son palabras de Stephen M. Hahn, Comisionado de la FDA, junto a Peter Marks, Director del Centro de Evaluación e Investigación Biológica.